Aufbau der Materie¶
Atome sind die kleinsten Bausteine eines jeden chemischen Stoffes. Sie können
nicht weiter zerteilt werden, ohne die charakteristischen Eigenschaften des
jeweiligen Stoffes zu verlieren. Ein Atom hat einen Durchmesser in der
Größenordnung von ![\unit[1 \cdot 10 ^{-10}]{m} = \unit[1]{\mathring{A}}](../_images/math/1cadb126513ae4a40c5b0ecb47326b01cbf4ab99.png) (ein „Angström“, benannt nach Anders Angström).
(ein „Angström“, benannt nach Anders Angström).
Alle Atome enthalten einen Atomkern, der fast die gesamte Masse eines Atoms beinhaltet. Er besteht aus Kernbauteilchen („Nukleonen“), also aus positiv geladenen Protonen und gleich schweren, jedoch ungeladenen Neutronen. Umgeben wird der Atomkern von einer nahezu masselosen Hülle aus Elektronen.
| Elementarteilchen | Zeichen | Ladung | Masse |
| Elektron | 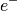 |
![q_{\mathrm{e}} = \unit[-1]{e}](../_images/math/5df4e14859624394740845e43ff7f48a80190dec.png) |
![m_{\mathrm{e}} = \unit[0,000\,55]{u} = \unit[9,109\,38 \cdot 10^{-31}]{kg}](../_images/math/f247712e9c3d6db731b35a7d441a2455e532f2ed.png) |
| Proton | 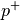 |
![q_{\mathrm{p}} = \unit[+1]{e}](../_images/math/f830241cd5f546649d93c891a04da888ce8ce355.png) |
![m_{\mathrm{p}} = \unit[1,007\,28]{u} = \unit[1,672\,62 \cdot 10^{-27}]{kg}](../_images/math/c8cb9e45bbdfac41a4a5fc233eef9deb5d31d29b.png) |
| Neutron | 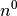 |
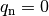 |
![m_{\mathrm{n}} = \unit[1,008\,66]{u} = \unit[1,674\,93 \cdot 10^{-27}]{kg}](../_images/math/f9d109a2c3a4a7f440ac21a009800fa0d746231d.png) |
Mit ![\unit[1]{e} = \unit[1,6022 \cdot 10^{-19}]{C}](../_images/math/cbc6ed44d613ce55abe04884ec6734b13b0ef63c.png) wird dabei die
Elementarladung bezeichnet. Ein Proton beziehungsweise Neutron ist jeweils um
ein rund
wird dabei die
Elementarladung bezeichnet. Ein Proton beziehungsweise Neutron ist jeweils um
ein rund 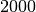 -faches schwerer als ein Elektron; der Durchmesser eines
Atomkerns ist zugleich jedoch um ein rund rund
-faches schwerer als ein Elektron; der Durchmesser eines
Atomkerns ist zugleich jedoch um ein rund rund 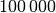 -faches kleiner
als die Elektronenhülle.
-faches kleiner
als die Elektronenhülle.
Elektronenhülle¶
Ein kann ionisiert werden, indem ein Elektron aus seiner Valenzschale in eine darüber liegende, noch unbesetzte Schale angehoben wird. Die für das „Anheben“ des Elektrons (entgegen dem elektrischen Feld des Atomkerns) der dazu Ionisierungsenergie nötig.
Bei chemischen Reaktionen findet eine Wechselwirkung zwischen den Elektronenhüllen zweier oder mehrerer Atome statt; die Atomkerne bleiben dabei unverändert.
Atomkern¶
Atomkerne („Nuklide“) setzen sich aus elektrisch positiv geladenen Protonen und
elektrisch neutralen Neutronen zusammen; sie haben einen Durchmesser in der
Größenordnung von ![\unit[10^{-15}]{m}](../_images/math/0ab63e3526ece6f413c311b7b81ae42580f49182.png) , sie sind also um das rund
, sie sind also um das rund
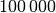 -fache kleiner als der Durchmesser der Atomhülle.
-fache kleiner als der Durchmesser der Atomhülle.
Die Nukleonen (Neutronen und Protonen) werden durch die sogenannte starke Wechselwirkung zusammengehalten. Diese anziehende Kraft ist im Bereich der kurzen Distanzen des Atomkerns sehr viel stärker als die abstoßende elektrostatische Kraft, die zwischen den positiv geladenen Protonen wirkt.
Die Anzahl der Protonen eines Atomkerns wird als Ordnungszahl 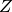 bezeichnet, da sie für jedes chemische Element charakteristisch ist. Die Anzahl
der Neutronen im Atomkern hingegen kann bei verschiedenen Atomen des gleichen
Elements variieren.
bezeichnet, da sie für jedes chemische Element charakteristisch ist. Die Anzahl
der Neutronen im Atomkern hingegen kann bei verschiedenen Atomen des gleichen
Elements variieren.
Die Summe der Protonen- und Neutronenanzahl wird als Massenzahl 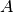 bezeichnet, da sie die Masse eines Atomes bestimmt. Zur Kennzeichnung des
Kernaufbaus wird die Massenzahl oben links, die Kernladungszahl
bezeichnet, da sie die Masse eines Atomes bestimmt. Zur Kennzeichnung des
Kernaufbaus wird die Massenzahl oben links, die Kernladungszahl 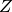 (Anzahl der Protonen) unten links neben das chemische Symbol geschrieben:
(Anzahl der Protonen) unten links neben das chemische Symbol geschrieben:
Beispiel:
- Für ein Helium-Atom mit zwei Protonen und zwei Neutronen schreibt man
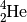 , denn die Kernladungszahl (Anzahl an Protonen) beträgt
, denn die Kernladungszahl (Anzahl an Protonen) beträgt
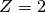 , und die Massenzahl (Anzahl an Prototonen plus Neutronen) beträgt
, und die Massenzahl (Anzahl an Prototonen plus Neutronen) beträgt
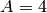 .
. - Für ein Kohlenstoff-Atom mit sechs Protonen und sechs Neutronen schreibt man
entsprechend
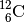 .
. - Für ein Uran-Atom mit
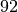 Protonen und
Protonen und 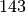 Neutronen schreibt
man entsprechend
Neutronen schreibt
man entsprechend 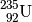 .
.
Wie das letzte Beispiel zeigt, muss in einem Atomkern die Anzahl an Protonen nicht mit der Anzahl an Neutronen übereinstimmen.
Auch für die drei Elementarteilchen Neutron, Proton und Elektron kann die obige Schreibweise verwendet werden:
![\begin{array}{rc}
\text{Neutron:} & \ce{_{\phantom{+}0}^1n} \\[8pt]
\text{Proton:} & \ce{_{\phantom{+}1}^1p} \\[8pt]
\text{Elektron:} & \ce{_{-1}^0e}
\end{array}](../_images/math/e0ef30974b5018f087f01d68ec870655249218b5.png)
Die Angabe einer „negativen“ Protonenzahl beim Elektron ist hierbei eine alternative Schreibweise für die Angabe der elektrischen Ladung. Allgemein wird bei der Beschreibung von Atomkernen die Ladungsangabe häufig weggelassen, da diese ohnehin stets eine positive Ladung tragen, die ihrer Protonenzahl entspricht.
Isotope
Chemische Elemente werden durch die Anzahl an Protonen im Atomkern charakterisiert; die Anzahl an Neutronen hingegen kann bei verschiedenen Atomen des gleichen Elements unterschiedlich sein. Atome, die aufgrund der unterschiedlichen Anzahl an Neutronen im Atomkern eine unterschiedliche Massenzahl besitzen, werden als Isotope bezeichnet.
Beispiele:
Für das chemische Element Wasserstoff sind folgende drei Isotope bekannt:
Bei „normalem“ Wasserstoff besteht der Atomkern aus einem einzelnen Proton:
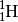
Dieses Isotop macht mit durchschnittlich
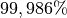 den größten Anteil
aller Wasserstoff-Atome aus.
den größten Anteil
aller Wasserstoff-Atome aus.Bei „schwerem“ Wasserstoff (Deuterium, Kurzform
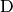 ) besteht der
Atomkern aus einem Proton und einem Neutron:
) besteht der
Atomkern aus einem Proton und einem Neutron: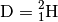
Deuterium macht mit durchschnittlich
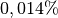 einen sehr kleinen
Anteil aller Wasserstoff-Atome aus.
einen sehr kleinen
Anteil aller Wasserstoff-Atome aus.Bei „sehr schwerem“ Wasserstoff (Tritium, Kurzform
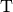 ) besteht der
Atomkern aus einem Proton und zwei Neutronen:
) besteht der
Atomkern aus einem Proton und zwei Neutronen: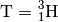
Tritium ist radioaktiv; in der Natur tritt es nur in kleinsten Mengen auf.
Für das chemische Element Sauerstoff sind ebenfalls drei Isotope bekannt. Es besteht durchschnittlich zu
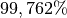 aus
aus 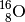 , zu
, zu
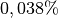 aus
aus 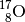 und zu
und zu 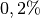 aus
aus
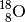 ; alle Isotope sind „stabil“ (nicht radioaktiv).
; alle Isotope sind „stabil“ (nicht radioaktiv).
Da für jedes chemische Element die Kernladungszahl 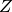 eindeutig
festgelegt ist, werden bei der Bezeichnung von Isotopen häufig nur die
unterschiedlichen Massenzahlen neben das Symbol des jeweiligen Elements
geschrieben, also beispielsweise
eindeutig
festgelegt ist, werden bei der Bezeichnung von Isotopen häufig nur die
unterschiedlichen Massenzahlen neben das Symbol des jeweiligen Elements
geschrieben, also beispielsweise 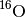 oder
oder 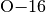 für das Sauerstoff-Isotop mit insgesammt
für das Sauerstoff-Isotop mit insgesammt 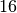 Nukleonen.
Nukleonen.
Abgesehen vom Massenunterschied besitzen Isotope weitgehend gleiche physikalische und chemische Eigenschaften.
Massendefekt¶
Die Masse eines Atomes entspricht nicht genau der Summe der Massen der Elementarteilchen, sondern ist stets etwas geringer. Dieser Masseverlust, der bei der Zusammenlagerung der Bausteine auftritt, wird als Massendefekt bezeichnet.
Ursache für den Massendefekt ist die bei der Zusammenlagerung der
Elementarteilchen frei werdende Bindungsenergie. Nach Albert Einsteins berühmter Formel – der
Äquivalenz von Masse und Energie – entspricht die Bindungsenergie 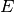 dem
Differenzbetrag
dem
Differenzbetrag 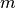 der Massen der Elementarbausteine und des gesamten
Atoms, multipliziert mit dem Quadrat der Lichtgeschwindigkeit
der Massen der Elementarbausteine und des gesamten
Atoms, multipliziert mit dem Quadrat der Lichtgeschwindigkeit ![c \approx
\unit[3 \cdot 10^8]{m/s}](../_images/math/41b2257d86bb0712617ccfc8b73a3350e6662f94.png) :
:
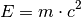
Bereits ein winziger Massendefekt entspricht einer gewaltigen Menge an Energie.
Beispiel:
Das Isotop
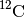 besteht aus je sechs Protonen, Neutronen und
Elektronen. Rechnerisch würde die Summe der Massen aller Atombausteine folgenden
Wert ergeben:
besteht aus je sechs Protonen, Neutronen und
Elektronen. Rechnerisch würde die Summe der Massen aller Atombausteine folgenden
Wert ergeben:![6 \cdot \unit[1,67262 \cdot 10^{-24}]{g} + 6 \cdot \unit[1,67493 \cdot
10^{-24}]{g} + 6 \cdot \unit[0,91094 \cdot 10^{-27}]{g} = \unit[2,009 \cdot
10^{-23}]{g}](../_images/math/01e2b49ff5638fcf867093fe35c777e7d6345fc4.png)
Die tatsächliche Masse des Isotops beträgt allerdings nur
![\unit[1,9924
\cdot 10 ^{-23}]{g}](../_images/math/ac34713d8ba2953ebdca91cae073ff8af5c09992.png) . Die Differenz von
. Die Differenz von ![m = \unit[1,66 \cdot
10^{-25}]{g}](../_images/math/2423ea4a75851c0b3900ca89315810a43282b92d.png) wird bei der Bildung aus den Kernbausteinen in Energie
umgewandelt. Diese Masse entspricht einer Energie von
wird bei der Bildung aus den Kernbausteinen in Energie
umgewandelt. Diese Masse entspricht einer Energie von ![\unit[1,494 \cdot
10^{-11}]{J}](../_images/math/55a92a3b0c7e5e9efd9825a369d8b5f117471a23.png) je Atom beziehungsweise
je Atom beziehungsweise ![\unit[7,5 \cdot 10^{11}]{J}](../_images/math/9915fe57b69ba086ec81e33e246849135b1dff9c.png) je Gramm
Kohlenstoff. Dies entspricht der 22-Millionen-fachen Energiemenge, die bei der
Verbrennung von einem Gramm Kohle freigesetzt wird.
je Gramm
Kohlenstoff. Dies entspricht der 22-Millionen-fachen Energiemenge, die bei der
Verbrennung von einem Gramm Kohle freigesetzt wird.
Massendefekte treten nur bei Kernreaktionen auf; bei chemischen Reaktionen ist lediglich das Zusammenwirken der äußeren Elektronen von Bedeutung.
